ALGUNAS NORMAS BÁSICAS PARA EL TRABAJO EN EL LABORATORIO...
1. Tiene que usar gafas de
seguridad mientras trabaje en el laboratorio. Los espejuelos no son substitutos
de las gafas. No se recomienda el uso de lentes de contacto.
2. Use zapatos cerrados.
3. Rotule los envases que contengan reactivos
o solventes. Incluya la fecha e iniciales del usuario.
4. Observe las precauciones de
uso indicadas en todos los envases de reactivos y solventes.
5. Devuelva los reactivos y solventes a su
lugar de almacenamiento.
6. Los materiales tóxicos o bien
volátiles deben manejarse dentro del “hood”. Asegúrese que el mismo está
encendido.
7. Use guantes y delantal de goma
para manejar corrosivos (ácidos o bases concentradas). Recuerde no añadir agua
a ácidos concentrados.
8. Para transportar envases grandes de
corrosivos colóquelos dentro de otro envase resistente a golpes y caídas.
9. Nunca encienda un mechero con
fósforos; utilice un encendedor apropiado.
10. NO pipetee soluciones con la boca.
11. Siga las instrucciones en los envases de
reactivos y solventes para disponer de desperdicios. Si tiene duda consulte a
su supervisor.
12. Observe buenas normas de higiene y
limpieza en el laboratorio.
13. No huela ni pruebe
sustancias.
14. Mantenga las puertas de gabinetes y
gavetas cerradas si no están en uso.
15. Mantenga al menos una puerta del
laboratorio abierta y sin cerradura en todo momento.
16. No obstruya el acceso a los instrumentos
con libros u otros objetos. No utilice libros para sostener instrumentos o envases.
17. Evite trabajar sólo y si lo
hace, notifique a alguien sobre el particular.
18. Todo equipo usado debe quedar limpio. No
almacene cristalería en los fregaderos.
19. Cierre las llaves de gas, aire comprimido
y agua al salir.
20. Apague las luces y demás
equipo eléctrico al salir.
21. Todo trabajo “en proceso”
debe rotularse como tal. Indique claramente la fecha y nombre del usuario.
22. Familiarícese con los equipos
de seguridad y primeros auxilios. Asegúrese que sabe usarlos.
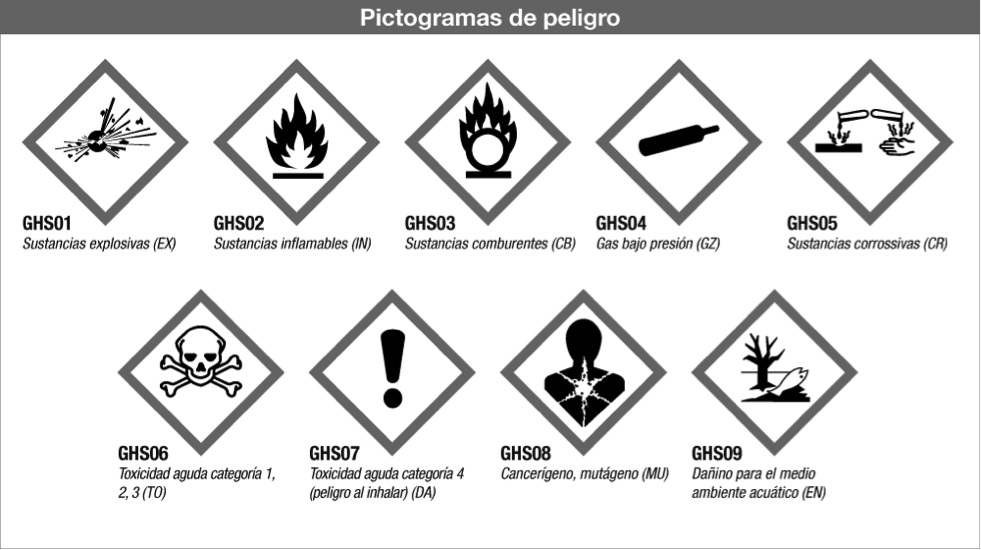
ALGUNOS PICTOGRAMAS DE USO EN LABORATORIOS